Pobranie krwi
do badań laboratoryjnych u królika
Esther van Praag, Ph.D.
Tłumaczenie: Teresa Pyza,
lek.wet. Dorota Pilich
MediRabbit.com is funded solely by the
generosity of donors.
Every donation, no matter what
the size, is appreciated and will aid in the continuing research of medical care
and health of rabbits.
Thank you
|
Uwaga: ten dokument zawiera
zdjęcia które mogą być nieodpowiednie dla niektórych osób.
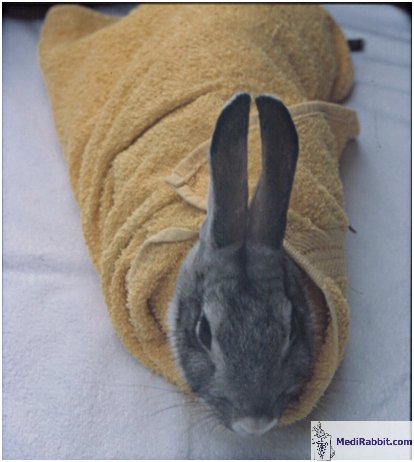
Króliki są płochliwe i mogą
podrapać manipulującą przy nich osobę albo zeskoczyć
ze stołu do badań lekarskich. Często w odpowiedzi na
próbę wkłucia do żyły brzeżnej ucha odpowiadają
energicznym szarpnięciem, jeśli wcześniej skóra nie
została znieczulona. Dlatego z reguły króliki przy wykonywaniu
powyższej czynności powinny być unieruchomione przez
owinięcie w ręcznik, torbę lub fartuch laboratoryjny.
For a pictorial demonstration of restraint in a towel, see: Safe immobilization
of a rabbit in a towel (“rabbit burrito”)
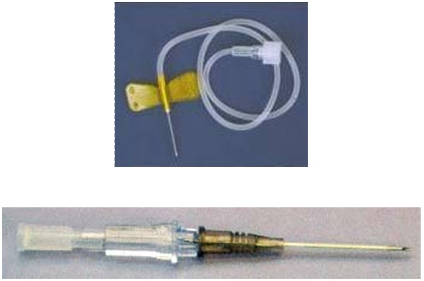
Mniejsze ilości krwi (do 5 ml) można pobrać z
żyły brzeżnej ucha przy użyciu igły o grubości
0,6 mm do 0,5 mm lub igły typu „motylek” (specjalna krótka igła do
wkłucia ze skrzydełkami) o grubości 0,6 mm
podłączonej do strzykawki lub probówki. Takie samo
przygotowanie żyły stosuje się kiedy jest konieczne
użycie igły z kaniulą.
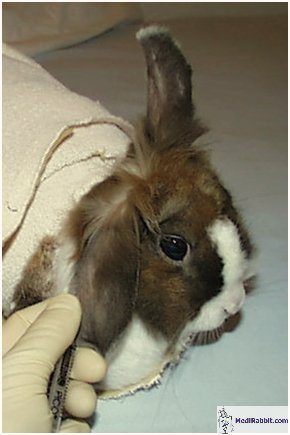
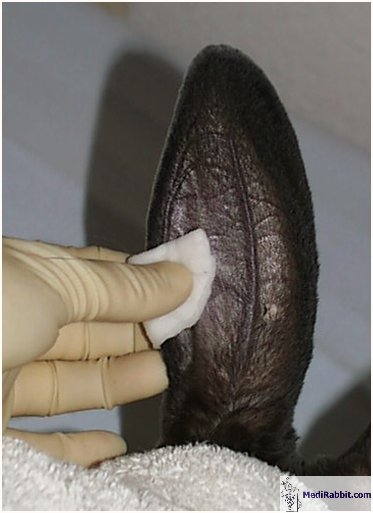
Usuwamy włosy z ucha golarką, skórę czyścimy
alkoholem. Skóra na uchu jest bardzo wrażliwa, z tego powodu jest
zalecane znieczulenie skóry w okolicach planowanego wkłucia
dożylnego przy użyciu kremu zawierającego lidokainę (np.
EMLA® firmy AstraZeneca). Miejsce które natarliśmy kremem
znieczulającym należy owinąć folią plastikową i
ochronnie przylepcem. Po 45 minutach cała grubość skóry jest
bez czucia a znieczulenie działa przez następne 60 minut.
Rozszerzenie naczynia krwionośnego uzyskujemy masując ucho,
zbliżając do ucha źródło ciepła lub przy użyciu
środków rozszerzających naczynia np. acetylopromazyny (0.25 ml,
podskórnie).
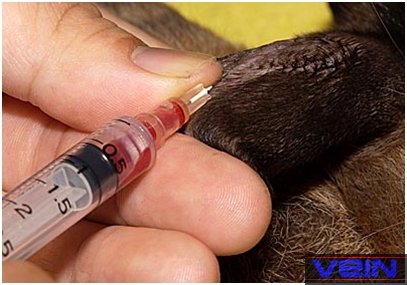
Po zamknięciu
(przez uciśnięcie) żyły wprowadza się ostrożnie
igłę i pobiera krew. Cała czynność musi być
wykonana powoli, tak aby zapobiec hemolizie czerwonych krwinek, jednak na
tyle szybko aby zapobiec powstawaniu zakrzepów. Po usunięciu igły
miejsce wkłucia uciskamy bawełnianym gazikiem przez przynajmniej 1
minutę lub do ustania krwawienia, żeby zapobiec powstawaniu krwiaków.
Nie powinno używać się do tego celu gazika nasączonego
alkoholem; alkohol powoduje rozszerzenie naczyń zapobiegając
krzepnięciu krwi.
Plamy krwi z ucha można usunąć wodą
utlenioną.
Do pobrania dosyć dużej ilości krwi można
użyć żyły szyjnej. Duże podgardle samic nie jest
przeszkodą. Królik może być umieszczony w kilku pozycjach tak
aby możliwe było pobranie krwi z żyły szyjnej:
- pozycja leżąca na
mostku, z szyją skierowaną do góry i przednimi kończynami
zwisającymi ze stołu do badań lekarskich,
- pozycja
leżąca na grzbiecie, po bezpiecznym unieruchomieniu królika przy
użyciu ręcznika wyciągamy szyję tak aby uwidocznić
żyłę szyjną;
- pozycja leżąca na boku, z szyją
wyciągniętą i przednimi nogami odciągniętymi w
dół.
Przed pobraniem krwi
usuwamy włosy. Nie należy pobierać krwi z żyły
szyjnej jeśli królik wykazuje zaburzenia oddychania.. U zwierzęcia
rzeczywiście w tym przypadku mogą podczas pobierania krwi
wystąpić objawy sinicy (cyjanozy).
Inne miejsca pobrania krwi to żyły
odpromieniowa i odpiszczelowa. Przebiegają tak samo jak u psów i kotów.
Żyły te są bardzo kruche, łatwo powstaje krwiak.
Należy unikać pobierania krwi z centralnej tętnicy
usznej, chyba że potrzebne są do pobrania większe ilości
krwi. To miejsce wkłucia jest bolesne i często w następstwie
dochodzi do niedokrwienia dalszej części ucha spowodowanej
utrudnieniem dopływu krwi do małżowiny usznej po utworzeniu
się krwiaka lub spowodowanej uszkodzeniem naczynia krwionośnego
(uraz naczynia z powstaniem zakrzepu). Co więcej, w przypadku kiedy
zastosujemy zbyt duży nacisk b. prawdopodobne jest zapadnięcie
się naczynia krwionośnego. Jeśli nie można
uniknąć użycia centralnej tętnicy usznej, wprowadzamy
igłę o grubości 0,8 mm do naczynia tak blisko czubka ucha jak
to jest możliwe. Krew powinna natychmiast zacząć
płynąć do strzykawki; kiedy jest ona już pełna,
można ją zastąpić nową odłączając
główkę igły
Królika powinno się obserwować przez następne
parę godzin żeby upewnić się że krwawienie w miejscu
wkłucia całkowicie ustało.
Kliniczne badania laboratoryjne krwi królika Podziękowania
Jestem winna podziękowania moim królikom Grijsje,
Florze i Stampi za ich cierpliwość. Podziękowania dla Akira
Yamanouchi za zgodę na użycie zdjęć z VEIN (Veterinary
Exotic Information Network, http://vein.ne.jp/).
Dalsze informacje
Mc Guill,
M.W. and Rowan, A.N. (1989) Biological effects of blood loss: implications
for sampling volumes and techniques. ILAR NEWS 31, No. 4, 5-18.
Exotic
Companion Medicine Handbook for Veterinarians, Cathy Johnson-Delaney and
Linda Harrison
Mader DR.
Rabbits - basic approach to veterinary care. In: Hillyer EV, Quesenberry KE
(eds.): Ferrets, Rabbits, and Rodents - Clinical Medicine and Surgery. Philadelphia, WB Saunders, 1997: 160-168.
Paul-Murphy J, Ramer JC. Urgent care of the pet
rabbit. In: Rupley AE (ed.): Vet Clin North Am (Exotic Anim Pract). Philadelphia, WB Saunders, 1998: 127-152.
|
|||||||||||
e-mail: info@medirabbit.com