Anesthésie: période per-anesthésique et
monitorage chez le
lapin
Esther van Praag, Ph.D.
|
MediRabbit.com est
financé uniquement par la générosité de donateurs. Chaque don, peu importe le montant, représente une contribution
considérable et aidera à la poursuite de la recherche sur les maladies, les
soins, et la santé des lapins. Merci |
Attention: ce texte contient
des images qui peuvent être pénibles pour certaines personnes.
|
Les
lapins sont souvent considérés comme des animaux difficiles en relation avec
l’anesthésie générale. Ceci est probablement dû au fait que les dosages
nécessaires pour induire et maintenir une anesthésie sont proches des doses
toxiques, qui produisent des effets toxiques et une variété d’effets
secondaires dus au stress et des réactions cardiaques et respiratoires.
L’anesthésie du lapin est néanmoins considéré comme sûre, si un minimum de précautions
sont prises tels un examen complet du lapin, l’utilisation d’agents
anesthétiques appropriés et un équipement qui n’est pas défectueux et faire
les différentes procédures sur un lapin calme. Comme
les lapins ne peuvent pas vomir, il n’est pas nécessaire d’éliminer la
nourriture et la boisson plus de 2 à 4 heures avant l’intervention
chirurgicale. En fait, les lapins dont la nourriture a été retirée sur longue
période de temps présentent une tendance accrue à devenir hypoglycémique
durant l’opération chirurgicale ou présentent des troubles digestifs après,
due à une dysbiose bactérienne. La croissance de bactéries pathogènes
entraîne le développement d’entéropathies. La guérison est par ailleurs
ralentie chez les lapins privés de nourriture pendant des heures avant
l’intervention. Il est ainsi recommandé de permettre au lapin de se nourrir
jusqu’à 2 à 4 heures avant l’intervention. Ceci permet d’assurer qu’il n’y a
pas de restes de nourriture dans la cavité orale et que l’estomac n’est pas
surchargé en nourriture et tendu. La nourriture et la boisson doivent être
immédiatement disponible après que le réveil du lapin Un traitement pré-anesthétique peut être
utile dans la préparation de l’anesthésie chirurgicale. Pour plus de détails,
voir: Anesthésie du
lapin. Part I Procédures pré-anesthétiques. Induction de l’anesthésie
générale
Le choix de l’agent anesthétique et la
voie d’administration dépend de la santé générale du lapin et du temps
nécessaire pour effectuer l’opération. L’administration intraveineuse
d’agents anesthétiques est la voie la moins sûre car la dose toxique de
certains agents anesthétiques est proche de celle nécessaire pour une
anesthésie générale.
Lorsque
l’intervention chirurgicale permet une anesthésie de courte durée, les
injections sous-cutanées ou intramusculaires sont préférées. Si la méthode
intramusculaire est choisie, des doses plus élevées d’anesthétiques doivent
être utilisées. En conséquence, le temps de réveil est plus lent et les
risques d’hypothermie sont accrus si un coussin chauffant (ou bouillotte)
n’est pas utilisé ou si les solutions de solutés ne sont pas chauffées à la
température du corps. Certains produits induisent des effets secondaires, par
exemple les lapins anesthésiés régulièrement avec une mixture de
kétamine/xylazine montrent un taux accru de maladies cardiaques et de
mortalité. Il est nécessaire de tenir compte de ces effets secondaires sur
une base individuelle, et en relation avec l’état de santé général du lapin.
D’autres lapins présentent une difficulté accrue et le réveil après la
procédure devient de plus en plus lent après des anesthésies répétées par
voie injectable, par exemple pour des traitements dentaires. Une liste des agents
anesthétiques et antagonistes sûrs
chez les lapins est disponible, avec la liste des effets secondaires
observés. L’anesthésie par inhalation de gaz
anesthésiant est la méthode la plus courante utilisée chez le lapin. Lorsque
cette méthode est choisie, une préparation préopératoire est recommandée. En
effet, les lapins commencent souvent à se battre aussitôt qu’ils sentent
l’odeur du gaz et peuvent se blesser en essayant de s’échapper (par exemple
fracture de la colonne vertébrale). Les agents couramment utilisés sont
l’isoflurane et le sévoflurane.
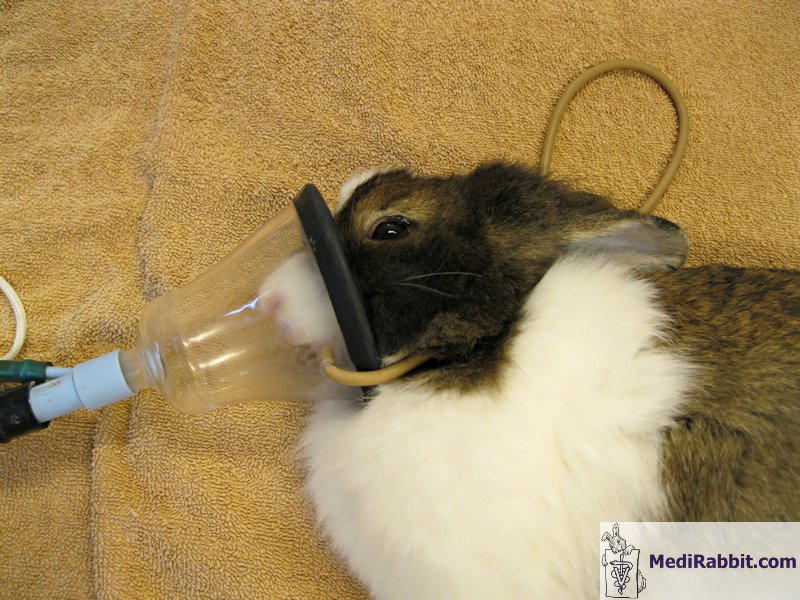
L’anesthésie par gaz peut être administrée
dans une chambre d’induction ou en plaçant un masque facial sur la face et en
tenant le lapin fermement.
Dans les deux cas, le lapin essayera de retenir
sa respiration, indépendamment de la méthode choisie. Plus rarement, de la
bradycardie (rythme cardiaque trop bas par rapport à la normale) ou une
détresse respiratoire est observée.
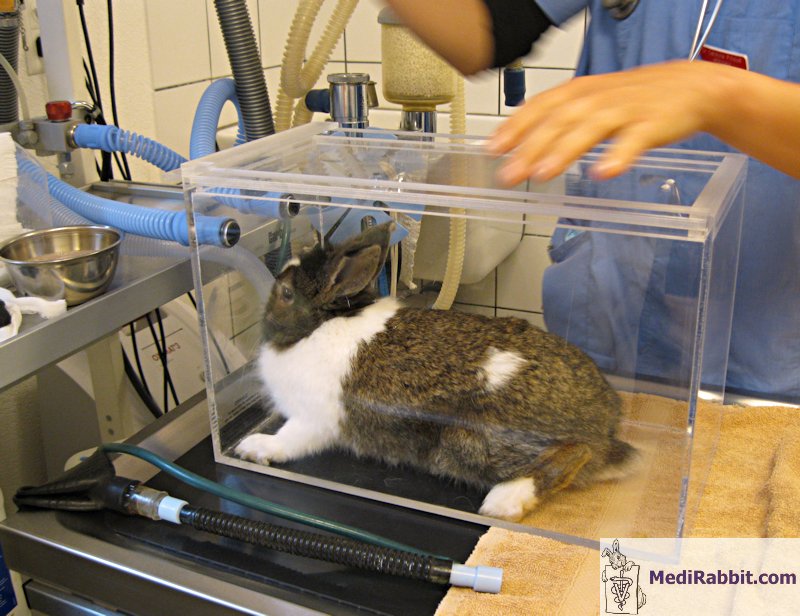
Préparation du lapin for une intervention chirurgicale
et monitorage des paramètres vitaux durant l’induction de l’anesthésie. Vidéo prise par Debbie Hanson. Lorsque des chambres d’induction sont
utilisées, il est conseillé de sortir le lapin s’il montre des signes de relaxation
et de lui placer un masque, placé profondément sur la face, afin de diminuer
l’espace mort.
Induction de l’anesthésie sur un lapin place dans un
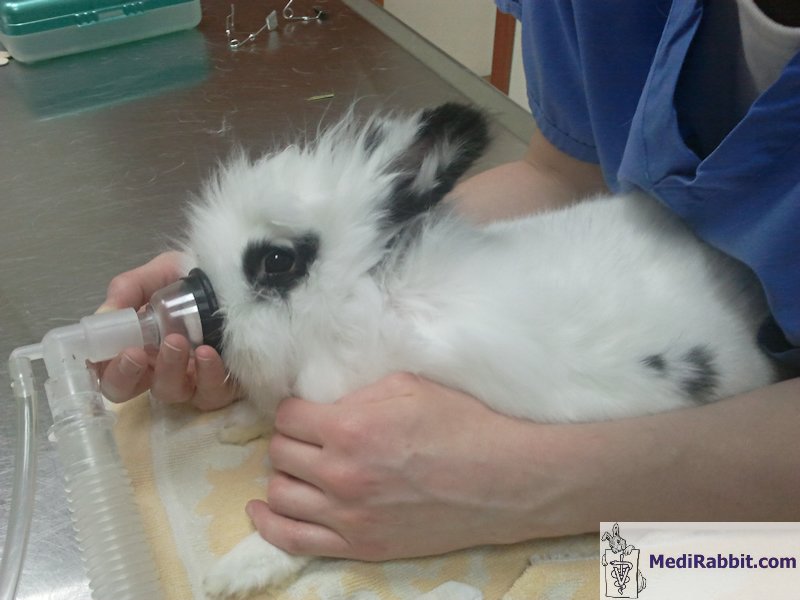
box d’induction. Vidéo prise par Elena Grisafi. Le masque présente l’avantage qu’il peut
être rapidement retiré et replacé dès que l’animal se remet à respirer
normalement. Lorsque le lapin refuse de respirer, il est possible de faire
une induction avec du propofol ou de l'étomidate, avant de replacer le masque
et continuer avec l’agent anesthétique inhalant choisi.
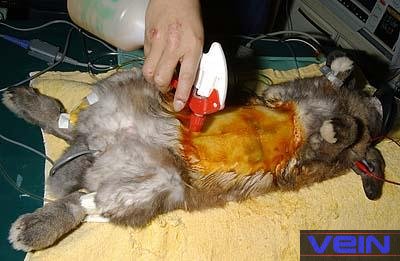
Monitorage de l’anesthésie
Après
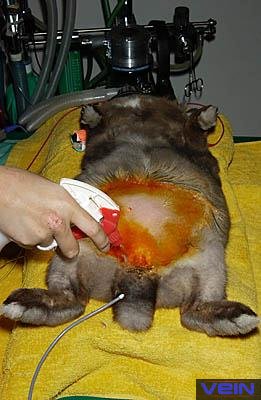
la phase d’induction, les préparatifs pour l’intervention chirurgicale peuvent
commencer. Ceux-ci incluent le rasage de la fourrure et la désinfection de la
peau. Avant que l’animal ne soit recouvert d’un drap chirurgical, le niveau
et la profondeur de l’anesthésie doivent être vérifiés. Des méthodes sûres
chez le lapin sont : • Réflexe
pédal, rétention de la respiration ou hypoxie, et cri: anesthésie de
profondeur légère; • Réflexe
palpébral (paupières), pincement de l’oreille ou réaction de rétraction
gauche: anesthésie de profondeur moyenne; • Réflexe
cornéen: anesthésie de profondeur dangereuse. Si une telle profondeur est
atteinte, un arrêt cardiaque peut avoir lieu. Des mesures d’urgence doivent
être entreprises, en réduisant ou arrêtant l’administration d’anesthétiques.
Exception : anesthésie avec la médétomidine. L’anesthésie
nécessaire à une intervention chirurgicale est atteinte lorsque les réflexes
après pincement de l’oreille et la tension musculaire au niveau de la
mâchoire sont perdus. Durant
l’anesthésie, la couleur des muqueuses (yeux, lèvres, langue), le taux respiratoire,
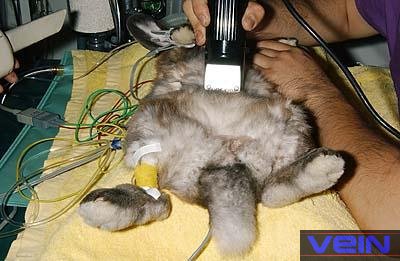
le rythme cardiaque et la température rectale doivent être surveillés. Monitorage des paramètres
vitaux
Monitorage du taux, du rythme et de la
profondeur respiratoire Le taux
de respiration dépend de l’agent anesthétique utilisé. En général, on observe
une diminution du nombre d’inspiration par minute, autour de 30 à 60. La
situation devient dangereuse lorsque le taux de respiration passe en dessous
de 30 inspirations par minutes ou à moins de 50% du taux normal. Une fois la
profondeur de l’anesthésie et les paramètres vitaux stabilisés, le taux de
respiration doit rester régulier et lent, quoique des changements rapides
sont parfois observés chez les lapins. Le taux
de respiration peut être contrôlé en observant le mouvement du thorax, si
aucun drap chirurgical n’est utilisé. Si ceci n’est pas possible, la
respiration doit être surveillée. Il faut mentionner que certains appareils
électriques sont incapables de mesurer le rythme rapide de respiration rapide
des lapins et autres petits animaux, et sont donc inefficaces. L’état
physiologique du lapin peut être suivi en vérifiant le taux de CO2
(capnographie). Dans ce cas, il est important de noter la tendance générale,
et non se focaliser sur les chiffres individuels. Si la capnographie est
utilisée, il faut tenir compte de l’espace mort de l’équipement et du masque
facial. le système non-aspiratif (mainstream) n’est ainsi pas recommandée. La
capnographie de type aspiratif (side-steam) est recommandée, même si le
volume de gaz échantillonné peut être grand en comparaison du volume d’air
inspiré et expiré à chaque mouvement respiratoire. Monitorage
du cœur et du rythme cardiaque Il est
important de suivre l’activité cardiaque chez les lapins anesthésiés En effet,
un examen préopératoire peut élever dangereusement le niveau de
catécholamines dans le sang (hormones du stress), entraînant des effets
désastreux comme une mauvaise oxygénation (hypoxémie) ou un excès de CO2 dans
le sang (hypercapnie). D’autres problèmes observés chez le lapin
incluent l’hypotension et un rythme cardiaque anormalement bas (bradycardie).
Le
rythme cardiaque du lapin est rapide et peut excéder 250 battements par
minute. Un électrocardiogramme peut être difficile à enregistrer, car les limites
supérieures des moniteurs sont atteintes (souvent placée à 250-300 battement
par minute), sauf lorsque la médétomidine ou la mixture kétamine/médétomidine
est utilisée (diminution à 120-160 battements par minute). Un
oxymètre permet de suivre le rythme cardiaque et le niveau d’oxygénation. Les
valeurs doivent typiquement rester à plus de 90% ; des valeurs moindres
indiquent que le niveau d’oxygène dans le sang est insuffisant (hypoxémie). De
signaux sûrs sont obtenus lorsque la sonde est fixée à la queue, les
oreilles, la langue ou aux doigts chez les espèces plus grandes. Un
arrêt cardiaque peut avoir lieu durant l’anesthésie. Cette urgence laisse peu
de temps pour intervenir proprement. En effet, chez les lapins les arrêts
cardiaques sont rapidement suivis par un arrêt respiratoire, et de la mort Monitorage de la température du corps Le contrôle de la température est
important chez le lapin: • La surface du corps est grande en rapport avec
la masse du corps: entraînant une perte rapide de la température; • Perte de température par convection et
radiation; • L’influence possible des agents
anesthétiques sur les mécanismes de contrôle de la température du corps; • un
équilibre doit être trouvé entre la surface minimum à raser au site de
l’intervention chirurgicale, et la quantité minimale de solution
antiseptiques à utiliser.
L’hypothermie tend à accroître
dangereusement la profondeur de l’anesthésie durant la procédure
chirurgicale. Ceci peut être accompagné d’hypoxie et d’acidose, d’arythmie
cardiaque et/ou de trouble du métabolisme des plaquettes du sang. La température corporelle du lapin
anesthésié peut être contrôlée grâce à un thermomètre électronique ou un
thermosenseur inséré profondément dans le rectum. Le maintien de la température corporelle
peut être assuré par des coussins chauffant, des bouillottes ou par des
convecteurs. Si des solutions de solutés doivent être administrées, celles-ci
doivent être chauffées à la température du corps. Remerciements
Merci beaucoup au Dr. Amir Maurer,
(Israel), à Elena Grisafi (Suisse), et à Akira Yamanouchi
(Veterinary Exotic
Information Network, Japan) pour la permission
d’utiliser leurs photos ici. Merci aussi aux vétérinaires Thomas et Caroline Pilloud (Cabinet vétérinaire du Brevil,
Boudevilliers, Suisse) pour leur coopération. Further Information
Dupras J, Vachon P,
Cuvelliez S, Blais D.
Anesthesia of the New Zealand rabbit using the combination of tiletamine-zolazepam and ketamine-midazolam with or
without xylazine. Can Vet J 2001;42:455-60. Flecknell PA, John M, Mitchell M, Shurey C, Simpkin S. Neuroleptanalgesia in the rabbit. Lab Anim
1983;17:104-9. Flecknell P. BSAVA Manual of Rabbit Medicine and
Surgery, Gloucester, UK: British Small Animal Veterinary Association 2000. Flecknell PA, Roughan
JV, Hedenqvist P. Induction of anaesthesia
with sevoflurane and isoflurane in the rabbit. Lab Anim
1999;33:41-6.
Harcourt-BrownOxford
F. Textbook of Rabbit Medicine, UK: Butterworth-Heinemann 2001 Hedenqvist P, Roughan
JV, Antunes L, Orr H, Flecknell
PA. Induction of anaesthesia with desflurane and isoflurane in the rabbit. Lab Anim 2001;35:172-9. Hillyer E.V. and Quesenberry
K.E. Ferrets, Rabbits, and Rodents: Clinical Medicine and Surgery, New York:
WB Saunders Co. 1997 Hobbs BA, Rolhall
TG, Sprenkel TL, Anthony KL Comparison of several
combinations for anesthesia in rabbits. Am J Vet Res 1991;52:669-74. Laber-Laird K. Handbook of Rabbit and Rodent
Medicine, Pergamon Veterinary Handbook Series)
Butterworth Heinemann 1996. Luo Y, Russell GB, Griffith JW, Lang
CM. Comparison of anesthesia induced by ketamine-fentanyl combination and
maintained by propofol or etomidate in New Zealand
white rabbits. Lab Anim Sci
1995;45:269-75.
Marini RP, Avison DL, Corning BF, Lipman NS. Ketamine/xylazine/butorphanol: a new anesthetic combination for rabbits.
Lab Anim Sci 1992;42:57-62. Robertson SA, Eberhart
S. Efficacy of the intranasal route for administration of anesthetic agents
to adult rabbits. Lab Anim Sci
1994;44:159-65.
Scheller MS, Saidman
LJ, Partridge BL. MAC of sevoflurane in humans and the New Zealand white
rabbit. Can J Anaesth 1988;35:153-6.
Troitzsch D, Vogt S, Peukert
A. Study of long-term anesthesia in rabbits. Tierarztl
Prax 1996;24:519-21. Weinstein CH, Fujimoto JL, Wishner RE, Newton PO. Anesthesia of six-week-old New
Zealand White rabbits for thoracotomy. Contemp Top Lab Anim Sci 2000;39:19-22. |
||||||||||||||||||||||
e-mail: info@medirabbit.com